发布时间:2025-05-26
浏览次数:0
细胞构成了生命的基石,人体内汇聚着超过三千亿个形态和功能各异的细胞。尽管这些细胞共享相同的遗传信息,但由于基因表达的不同,它们在形态、功能以及最终的命运上展现出了极大的多样性。基因的表达过程受到表观遗传机制,如染色质可及性的直接影响——只有当染色质处于开放状态时,相应的基因才有可能被转录并发挥其作用。深入探究这两种物质在单一细胞层面的相互影响,对于阐明生理功能的正常运作以及疾病发生发展的复杂机理具有极其重要的意义。
在众多癌症种类中,肿瘤细胞呈现出明显的遗传及表观遗传差异,同时,肿瘤微环境中的免疫细胞由于状态变化频繁和功能的多重性dnastar lasergene,使得这种复杂性得到了进一步的强化。尽管如此,目前广泛使用的单细胞多组学技术常常受到诸如通量、成本、数据质量以及复杂组织适用性等方面的限制,因此,它们在处理大规模肿瘤样本分析时显得力不从心。
4月21日,清华大学生命科学学院、北京生物结构前沿研究中心以及清华-北大生命科学联合中心的张强锋副教授领导的课题组,携手北京301医院第一医学中心胸外科的冯长江副主任医师,于《细胞·系统》(Cell)期刊上成功在线发布了题为“在同一细胞内同步解析染色质开放性与基因活动,揭示癌症特有调控机制”的研究论文。
该研究成功研制出一种名为-seq的单细胞多组学测序技术,此技术能够在同一单细胞内高效、经济地同时检测基因表达(scRNA-seq)和染色质开放性(-seq)。-seq技术巧妙融合了组合式条形码标识与微液滴测序手段,运用了“微液滴过载”策略,极大地增强了单次实验的效率和数据处理能力。-seq技术的一大特点是,它能在一次实验中同时分析数十万甚至百万个细胞,这极大地促进了多种样本的多组学联合分析,显著减少了批次效应的干扰;在获取高标准的基因表达和染色质可及性单细胞联合数据的同时,其单个细胞的成本仅为目前技术(例如)的约三分之一。这些显著优势使得-seq技术非常适合用于大规模样本在单细胞层面的基因表达调控研究。
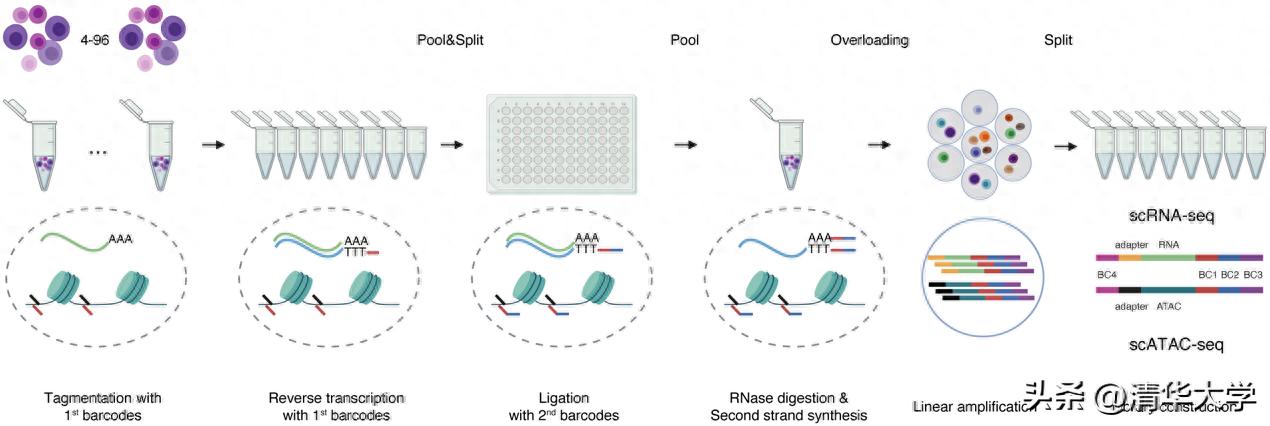
通过结合序列分析及组合索引技术,以及运用微液滴过载技术,对同一单细胞内的染色质开放性和基因表达水平进行同步检测。
在这项研究中,研究团队对40份人类肺癌临床样本进行了-seq技术分析,其中包含22份肿瘤样本和18份相应的癌旁组织样本。通过这一技术,他们成功构建了超过20万个高质量单细胞的联合组学图谱。依托这一庞大的数据集,研究团队实现了多项关键性突破。研究详尽地展现了肺癌微区中细胞构成的复杂性,通过结合基因表达和染色质开放性的分析,成功鉴定了免疫细胞、基质细胞以及上皮细胞等八大主要细胞群体,同时还将T细胞细分为十四个功能多样的亚型。这种分析并非沿袭传统基因表达细胞分型方法,它融合了染色质开放性数据,因而能够展现那些在单一组学中难以分辨、却能在联合组学特征中清晰辨识的细胞功能状态。例如,研究揭示了处于不同状态的T细胞在表观遗传调控作用下的丰富多样性,这一发现为深入理解肿瘤免疫反应的机制提供了新的观察角度。
同样,凭借综合基因表达和染色质开放性数据的分析,-seq技术显著提升了解析基因组不稳定性的能力,成功识别出多种与肺癌进展紧密相关的拷贝数变异事件以及具有侵袭性的肿瘤细胞亚群。研究在单细胞水平上对染色体外环状DNA与基因表达进行了并行分析,结果显示,携带肿瘤的细胞中,与上皮-间质转化相关的转录因子,例如SOX4,其表达水平显著升高,这表明这些因子可能在肿瘤的发展过程中扮演着至关重要的角色。
尤其关键的是,在单个细胞内部获取基因表达及染色质开放程度的相关信息,这有助于我们构建出高清晰度的细胞类型特异性的增强子与靶基因相互作用图。研究因而揭示了众多免疫与肿瘤核心基因或许受特定增强子的调节,同时,研究者们还开发出了识别多个增强子区域功能变异的方法,这些变异中的一些可能通过干扰转录因子的结合来影响基因的活性,这暗示了增强子变异在肿瘤的发生与发展过程中,以及调控失衡中所扮演的潜在角色。
-seq技术为在单细胞层面系统性地解析基因表达与染色质状态的调控机制,提供了一种高效、经济且易于扩展的新手段。肺癌样本的研究中,该技术展现了卓越的解析细胞类型、功能状态及其调控网络的能力,并进一步揭示了肿瘤亚克隆的遗传差异、免疫细胞的表观异质性,以及潜在功能性增强子的突变现象,从而突显了它在肿瘤异质性研究和癌症调控机制解析方面的显著优势。在不久的将来,-seq技术有望应用于更广泛的疾病模型和组织类型,同时与空间组学、蛋白质组学等先进技术实现深度结合,这将促进多组学数据的整合与分析dnastar lasergene,从而为精准医疗领域带来更为全面和精细的解决方案。
张强锋副教授,来自清华大学生命科学学院及北京生物结构前沿研究中心,与北京301医院第一医学中心胸外科的冯长江副主任医师共同担任本论文的通讯作者。此外,清华大学生命科学学院的博士后唐磊、张劲松以及2017级博士生邵燕秋并列第一作者。已毕业的2015级博士生魏逸凡、博士后李雨哲和田康也对论文的完成做出了关键性的贡献。该研究得到了国家重点研发计划、国家自然科学基金、北京生物结构前沿研究中心以及清华-北大生命科学联合中心等多家机构的资金扶持,同时,清华大学膜生物学国家重点实验室和高通量筛选平台药物技术中心为其提供了必要的技术保障。
论文链接:
Cell期刊的网址为www.cell.com,该网站链接为cell-//S2405-4712(25)00099-7。
如有侵权请联系删除!
Copyright © 2023 江苏优软数字科技有限公司 All Rights Reserved.正版sublime text、Codejock、IntelliJ IDEA、sketch、Mestrenova、DNAstar服务提供商
13262879759

微信二维码