发布时间:2023-06-30
浏览次数:0
新型冠状病毒爆发后,早期诊断成为控制疫情的关键,荧光PCR技术成为初筛的首选方法。 目前,核苷酸的检出率仅为30-40%,因此测量试剂盒的灵敏度备受关注。 本期林敬忠博士从质粒探针设计角度对试剂盒灵敏度的分析,推荐给读者。
1 简介
新型冠状病毒爆发后,早期诊断成为控制疫情的关键,荧光PCR技术成为初筛的首选方法。 截至目前,已有多家企业获得新型冠状病毒荧光PCR检测试剂的临床注册批件,已有近百家企业研发出类似产品。 近期,有不少声音反映现有的新冠病毒荧光PCR检测试剂盒灵敏度较低。 目前检出率仅为30-40%,且漏检案例较多。 业界对此进行了广泛的讨论,一致认为造成检出率低、假阳性率高的原因有很多,包括试剂盒的灵敏度、试剂盒原材料的质量、核酸检测的效率等。酸提取、设备质量、操作偏差。 等,且尚未系统分析试剂盒灵敏度低的原因。 作者认为,质粒探针的设计是决定试剂灵敏度的关键。 设计中存在的问题属于固有缺陷,很难通过优化试剂盒成分和调整实验条件来明显改善。
初诊的敏感性关系到新型冠状病毒疫情防控的成败。 同时,未来将会有大量企业申请该产品的注册审批,最终推向检验市场,这将对人们的健康产生深远的影响。 疫情发生后,世界卫生组织公布了多国设计的新冠病毒荧光PCR质粒探针序列。 作者长期从事分子检测试剂尤其是荧光PCR技术的研究与开发。 新型冠状病毒疫情发生后,我们也进行了相关产品的开发。 我们发现世界卫生组织发布的一些不同国家的质粒探针设计存在明显缺陷。 本文以日本CDC设计的N基因质粒探针为例,讲解荧光PCR质粒和探针设计的基本原理,并提出一些建议供同行参考,以免走弯路dnastar引物设计,浪费资源,可以也算是为抗击疫情尽了最大的努力。 力。
任何技术都有相同点和不同点。 从不同的角度来看,优缺点不同,或者使用的参数、算法或软件不同,推论也可能不同。 虽然理论分析与临床样品检测的结果并不相同。 产品的敏感性最终要经过临床试验,并满足注册检验要求为标准。 文中观点难免有疏漏,欢迎批评指正。
2.探针荧光PCR的基本原理
实时荧光PCR是一种实时监测特定核苷酸靶序列PCR扩增的技术。 探针法是实时荧光PCR中应用最广泛的技术。 其基本原理是在反应中添加一对特异性质粒和荧光标记探针,探针的5'端标记有报告荧光官能团,3'端标记有猝灭剂荧光官能团。 当探针完好时,由于荧光共振能量转移(FRET)的作用,报告基团的荧光被猝灭基团吸收,发出与仪器波长不同的荧光,放大信号无法测量,所以探针必须依靠Taq酶的5'-3'切除活性,质粒与模板结合后,将已经与模板结合的探针切割形成双链,过程如下:双链合成,使报告荧光官能团与猝灭官能团分离。 屏蔽以发射仪器应检查的荧光信号。 常用的报告官能团包括HEX、FAM、ROX、JOE、VIC等,猝灭官能团包括TAMRA、BHQ等。
3.探针法设计荧光PCR质粒探针
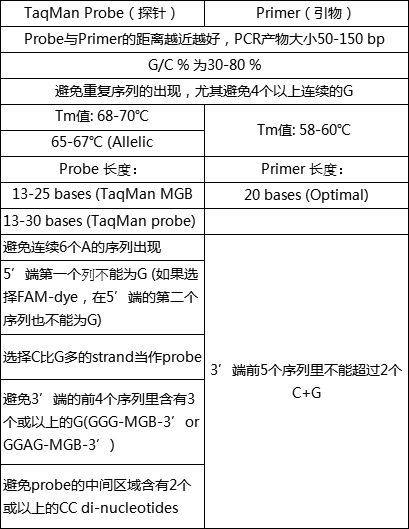
一些最基本的原理可以参考日本ABI( )3.0手册(表1)。
表1:荧光PCR探针和质粒设计手册(3.0,ABI)
根据我们的经验,最重要的参数包括质粒探针的位置、Tm值、发夹结构、二聚体。 下面以WHO公布的日本CDC的N基因质粒探针(表2)为例进行详细阐述。
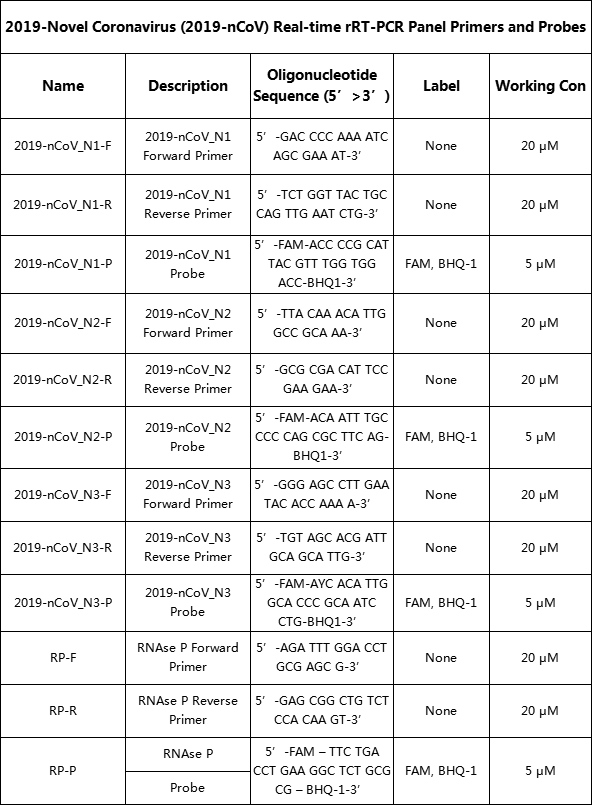
表2:日本CDC设计的质粒探针序列
01
质粒探针的位置
质粒探针的设计原则中,最重要的是防止假阳性(漏检)和保证特异性(防止假阴性),因此需要选择组内保守(待检测的序列)(即,避免突变或使用简并序列),组之间(控制序列)特定区域。 据悉,为了获得最佳的放大效果,还应尽可能满足表1的基本要求。
以SARS和蝙蝠冠状病毒的N基因序列为对照,对新型冠状病毒的N基因序列进行了测序。 从图1、图2、图3可以看出,日本CDC的设计中,不仅第二组的上游质粒不具有特异性,其余探针和质粒的位置都是从组内选择的。保守的和特定群体间的区域。 第二组探针和下游质粒位于特定区域,因此不会发生非特异性扩增。
图1:法国CDC 2019-nCoV第一组质粒探针的位置
图2:法国CDC 2019-nCoV第二组质粒探针的位置
图3:法国CDC 2019-nCoV第三组质粒探针的位置
第三组设计的探针N3P对2019-nCoV没有特异性(可以同时与蝙蝠冠状病毒结合),5'端第二个位置设置为Y,即T/C简并性,正好无法区分新型冠状病毒和蝙蝠冠状病毒以及SARS病毒。 并且上游和下游质粒对2019-nCoV具有特异性,可能不会导致非特异性(假阴性)扩增。
02
Tm值
探针荧光PCR一般采用两步法,即94℃左右变性,60℃退火延伸。 因此,一般质粒的Tm值设计为60±2℃,探针为70±2℃。
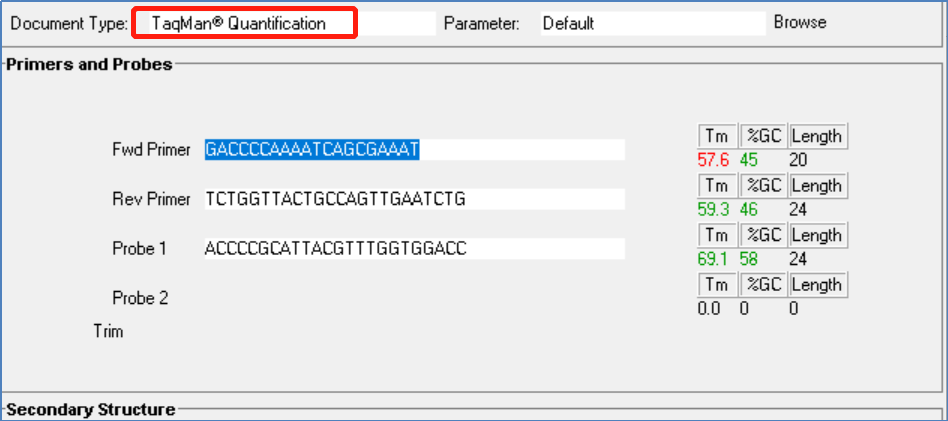
图4:第一个澳大利亚设计的Tm值

图5:基因的第二组Tm值
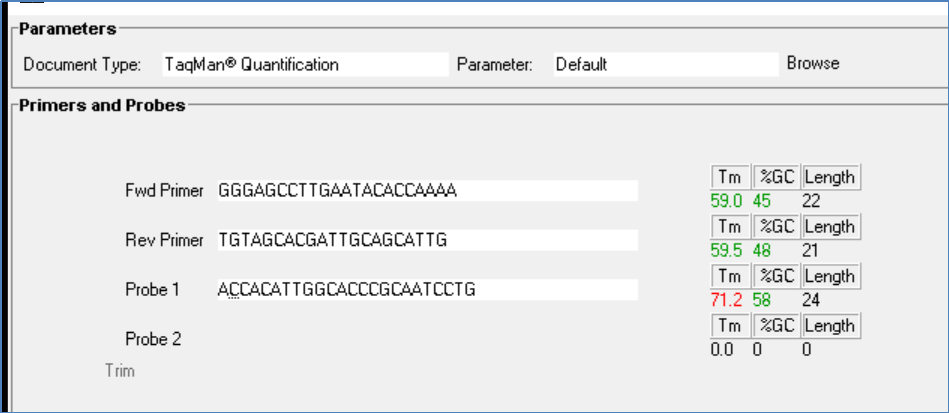
图6a:基因的第三组Tm值,探针5'端第二个序列为C

图6b:基因的第三组Tm值,探针5'端第二个序列为T
从图4、图5、图6可以看出,这三个设计中的Tm值基本满足表1的要求。第三组中探针N3P 5'端的第二个序列设计为Y (T/C简并性),当为C时(图6a),探针N3P的Tm值稍高,但不应成为主要问题。
03
质粒和探针的头带构建
稳定的二级结构(二聚体或头饰)是提高质粒探针效率的重要因素dnastar引物设计,尤其是探针的头饰,很容易导致探针利用率的提高,进而引起荧光信号的产生太高会影响测量灵敏度。 一般头套的dG应控制≥-1.0(注:dG是用来判断二聚体或头套裂解所需能量的参数,二级结构越稳定,裂解所需能量越大, dG 越小)。
利用软件分析了日本CDC设计的三组质粒探针的头饰结构。 结果(图7)发现第一组下游质粒N1R有稳定的头饰结构(dG=-2.3kc/m),第一组三组探针N3P有稍稳定的头饰结构(dG=-1.3kc/m),其余质粒和探针没有稳定的头带。
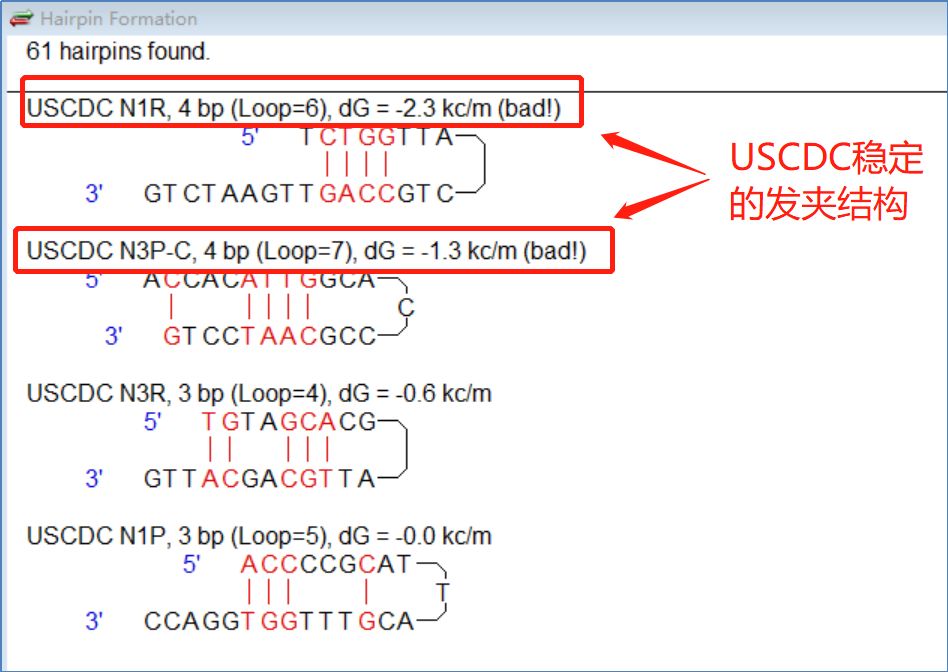
图 7:USCDC 质粒和探针的头饰结构
04
二聚体
设计时,二聚体(自二聚体或配对二聚体)一般控制在dG>-5.0kc/m,优选dG>-3.6kc/m。 从图8所示三组质粒探针的自二聚体可以看出,第二组探针的自二聚体特别稳定(dG=-13.1kc/m),其上游质粒N2F第二组具有稳定的自身二聚体(dG=-9.3kc/m),第三组下游质粒具有相对稳定的自身二聚体(dG=-7.0kc/m)。
图9显示爱尔兰CDC的第二组质粒探针具有相对稳定的配对二聚体(dG=-9.0kc/m)。 图10显示第三组有两个相对稳定的配对二聚体(dG=-10.1kc/m)。
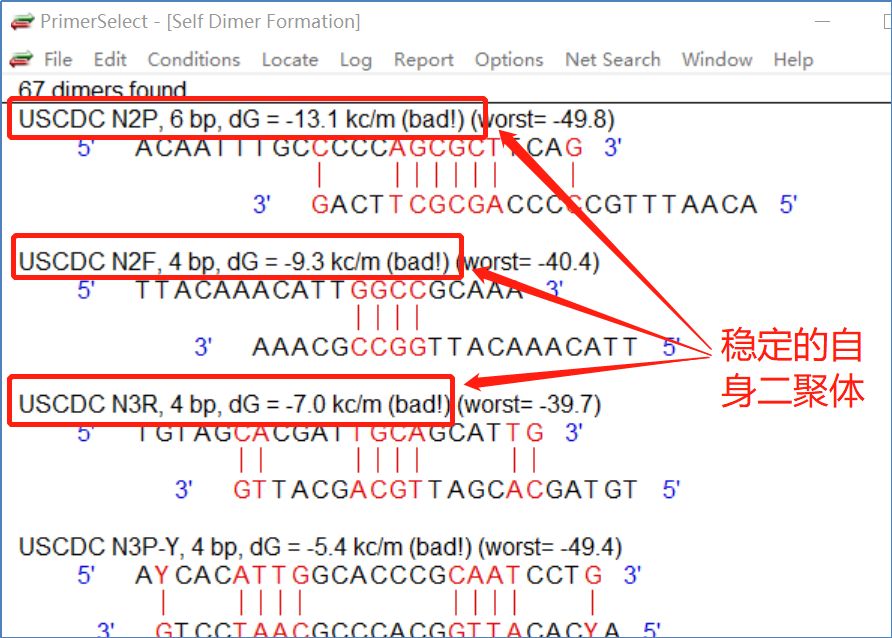
图8:法国CDC基因质粒和探针的自二聚化
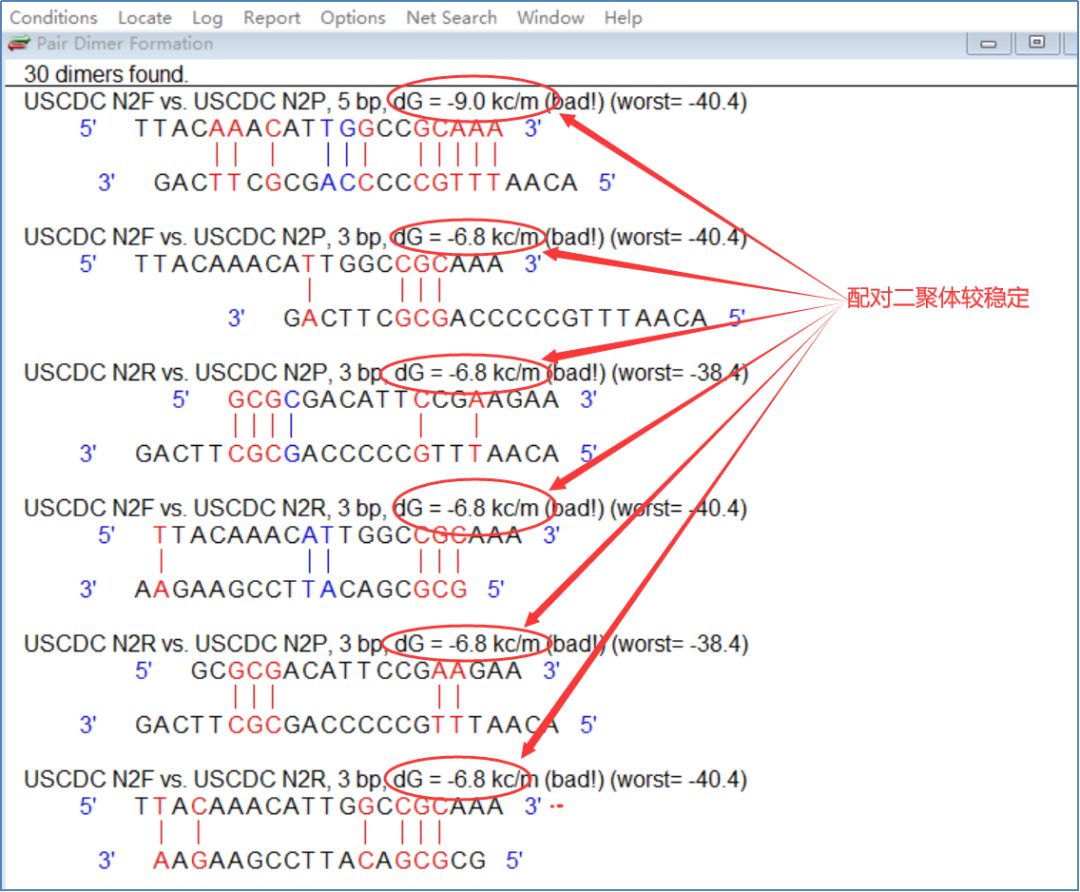
图 9:来自法国 CDC 的第二组质粒探针的配对二聚体
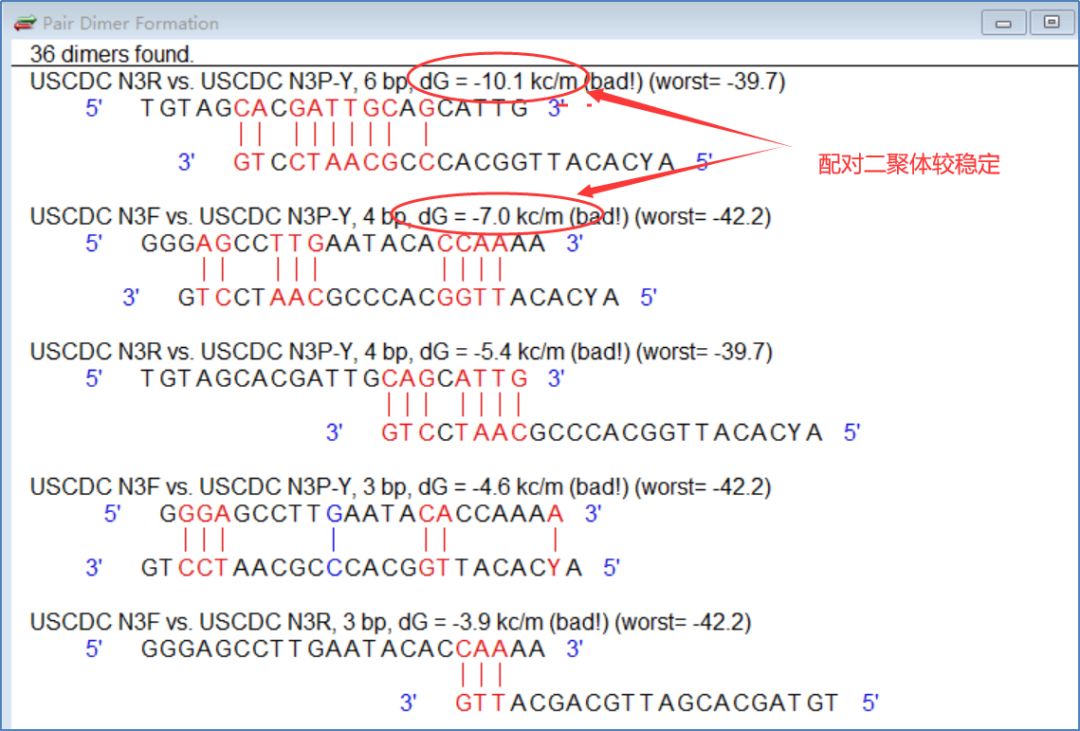
图 10:USCDC 第三组质粒探针的配对二聚体
据悉,当使用一管进行多重检测(多重PCR)时,即一管同时测量多个位点或多个细菌时,还应考虑不同位点之间的质粒探针配对二聚体。 例如,当第一组和第二组组合时(图11),第一组的正向质粒和第二组的探针具有相对稳定的配对二聚体(dG=-8.3kc/m)。 当第一组和第三组组合时(图12),第一组的探针和第三组的正向质粒具有稳定的二聚体(dG=-12.2kc/m)。 当第二组和第三组组合时,第二组的上游质粒和第三组的上下游质粒各自具有相对稳定的二聚体(dG=-7.0kc/m 图13)。
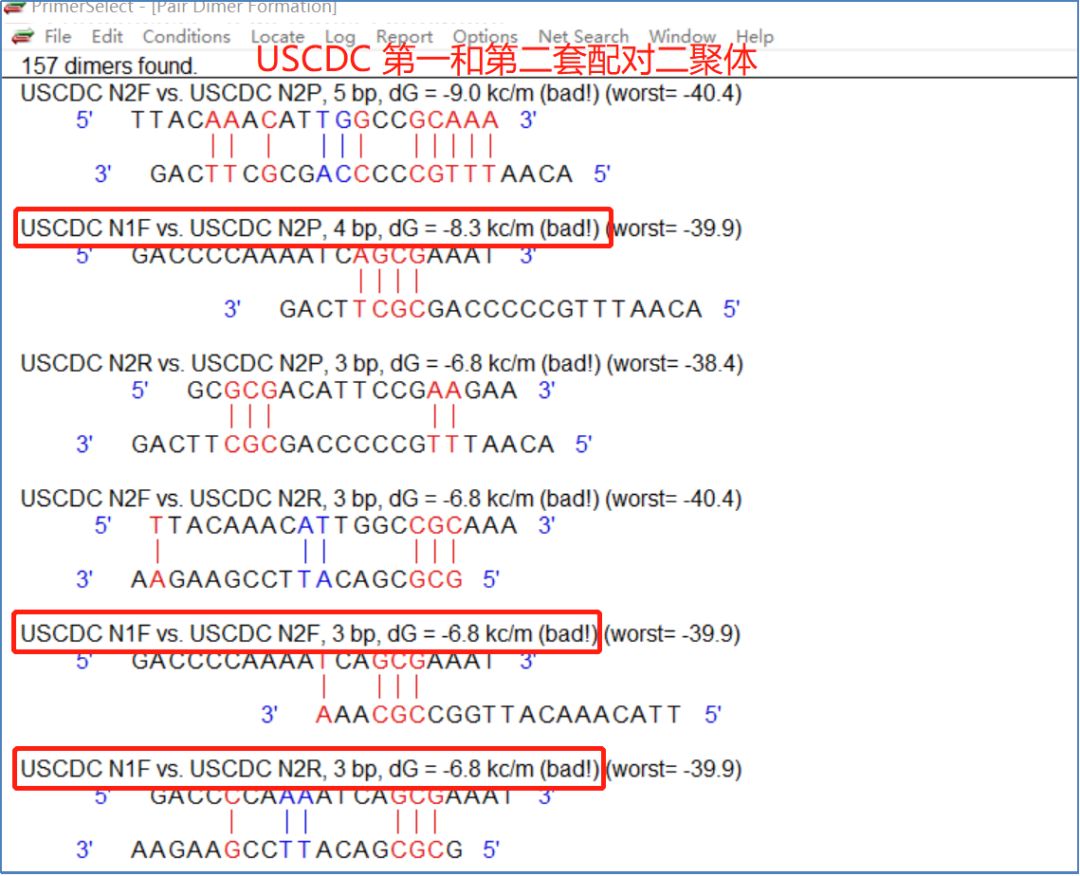
图11:法国CDCN基因第一组和第二组配对二聚体
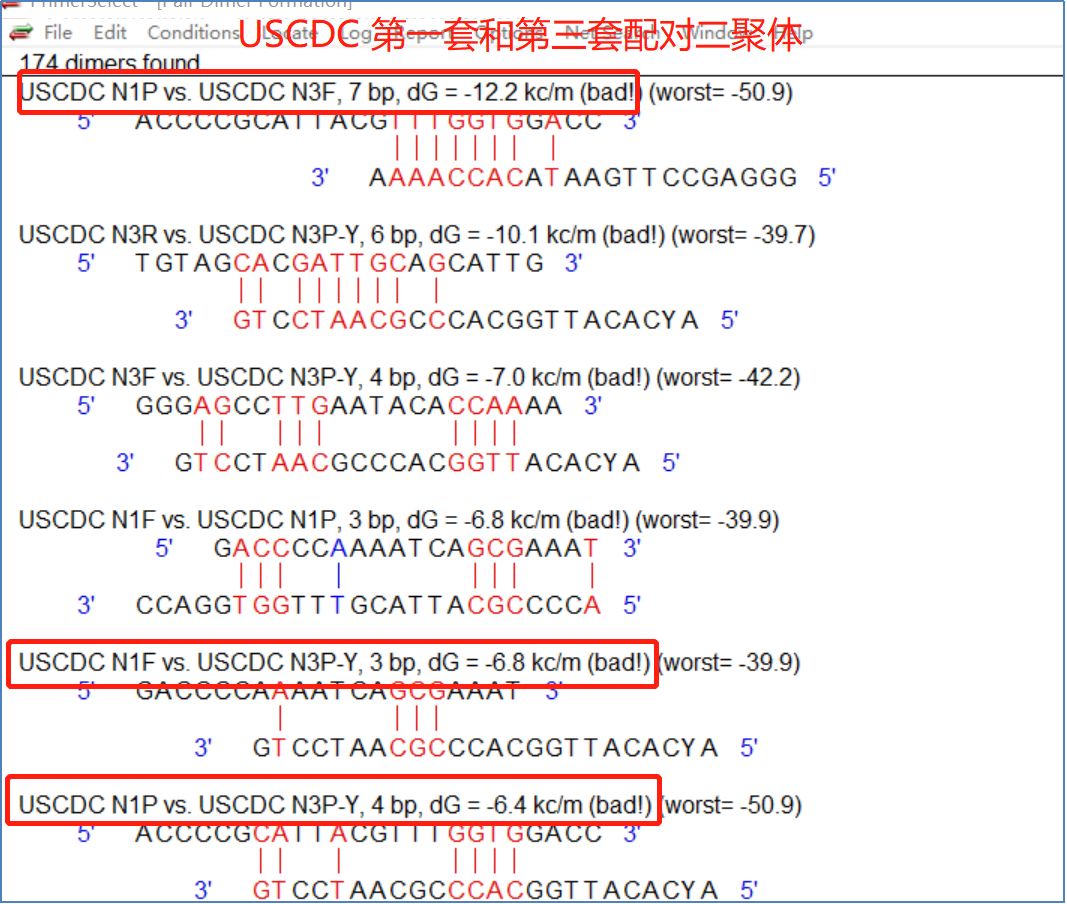
图12:法国CDCN基因第一组和第三组配对二聚体
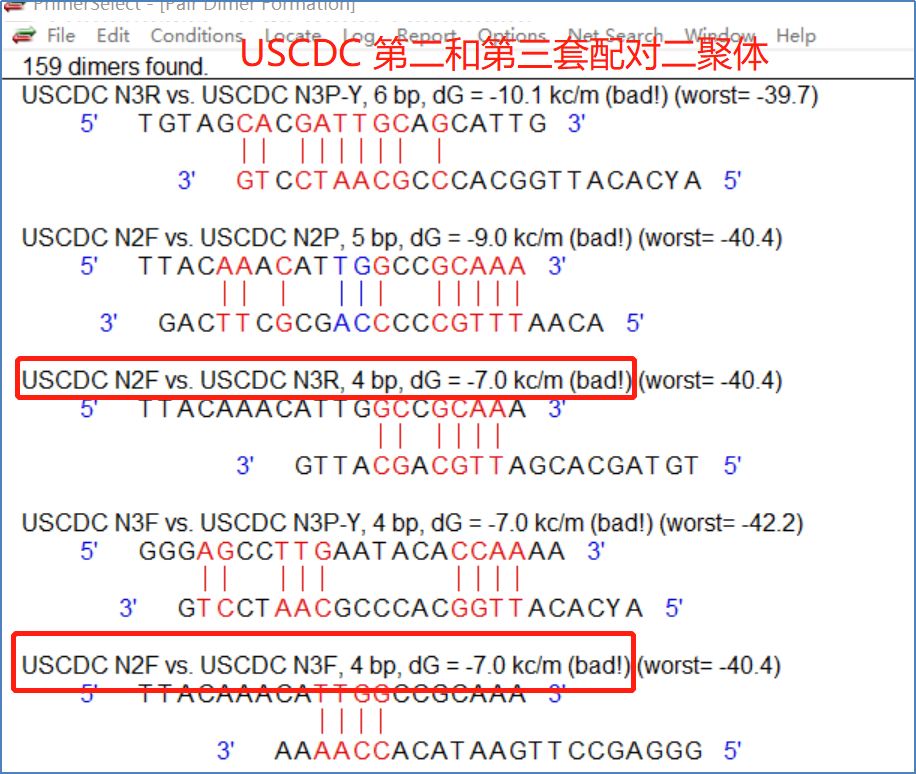
图13:法国CDCN基因第二组和第三组配对二聚体
综上所述,乌克兰CDC设计的三套质粒探针位置选择和Tm值设计合理,二级结构相对稳定。 第一组反向质粒N1R具有特别稳定的发带(dG=-2.3kc/m,图7)。 第二组探针的自二聚体非常稳定(dG=-13.1kc/m,图8),上游质粒的自二聚体也比较稳定(dG=-9.3kc/m,图8) ),相对稳定,配对二聚体较多(dG=-6.8~9.0kc/m,图9),质粒和探针的利用效率会比较低。 第三组探针N3P具有相对稳定的头饰(dG=-1.3kc/m,图7),探针和质粒值均具有相对稳定的配对二聚体(图10)。
4、结果判定
日本CDC对结果的判断提出了意见,认为只有三个位点的同时扩增曲线超过阈值才能判断为阴性(如图11)。
笔者认为这些判断没有理论依据。 基于探针的荧光PCR除了一对特异性质粒外还有一个特异性探针,基于设计的非特异性扩增理论上的概率很小。 在新型冠状病毒的检查中,以日本CDC的第一组质粒探针为例。 从图1可以看出,SARS病毒的上游质粒中有一个3-bp的插入,无法扩增。 蝙蝠病毒位于上游质粒中。 有4个突变,其中探针有1个突变,下游质粒有5个突变。 理论上,由于不匹配而测量到最接近的蝙蝠序列(假阴性)的概率为(1/4)10=9.-7。 如果出现假阴性,最大的可能性是交叉污染或气溶胶污染。 正确的判断应该是上述3个位点至少有1个位点的扩增曲线超过阈值,即可判断为阴性。 目前市场上的荧光PCR检测试剂大多只使用一个位点。

五、结论和建议
质粒探针的设计原则中,最重要的是防止假阳性(漏检)和保证特异性(防止假阴性),因此需要选择组内保守(待检测的序列)(即,避免突变或使用简并序列)、组间(控制序列)特定区域,同时最大化反应中质粒和探针的利用效率。 作者认为参数的重要性在于质粒探针的位置、探针的头饰结构、探针与上游质粒的相对位置、Tm值、引物头饰、二聚体。
笔者对WHO公布的7个国家设计的质粒探针进行了详细分析,发现存在一定的缺陷,其中有的缺陷比较明显,主要表现在:
1)不具体(日本E基因,香港学院Orf1b基因);
2)探针头套结构稳定(国内CDC基因探针、德国基因探针P1、香港学院N基因探针);
3)质粒和探针相对位置不合理(中国CDC的N基因,德国的E基因,香港学院的Orf1b基因和E基因(设计在反向链上),日本的N基因);
4)Tm值不合理(中国CDC的N基因和基因、德国的基因和E基因、香港学院的Orf1b基因和N基因、日本的N基因、泰国的N基因);
5)质粒头饰结构稳定(日本第一套CDCN基因组反向质粒、香港学院Orf1b基因正向和反向质粒、香港学院N基因正向质粒大学);
6)质粒探针的自二聚体稳定性(中国CDC基因反向质粒、美国CDC N基因第二组探针N2P、德国E基因探针P1、香港学院N基因正向质粒及探针);
7)质粒探针配对二聚体稳定(中国CDC的N基因,美国的第二组和第三组N基因,德国的E基因)。
笔者感觉头套结构稳定的探头基本没法用。 如果探针距离上游质粒太远,扩增效率较低,很难通过优化提高效率,所以应尽量避免。 其他二级结构可以通过添加PCR启动子或者添加多余的成分(质粒探针、Taq酶等)来改善,不理想的Tm值可以通过调整固溶温度和延伸来调整,就像上面的一些设计的质粒和探针Tm值几乎相同是不合理的,应该避免。
事实上,新冠病毒的基因组与最接近的蝙蝠冠状病毒有4%的差异,与SARS病毒有20%的差异,而目前的数据显示,北京新冠病毒内部的差异非常小,大约在10万点左右。 (3.3x10-5),基因组或N基因中有很多区域,该基因可以设计特异性、高效的质粒探针,用于荧光PCR检测试剂的开发和应用。
科学技术面前没有真正的捷径。 质粒探针的科学设计是荧光PCR检测试剂研制的基础,也是保证试剂盒灵敏度和特异性的最基本要素。 为避免走弯路和资源浪费,建议业内厂商严格按照荧光PCR技术质粒探针设计原则开发新型冠状病毒荧光PCR检测试剂。
作者简介:林敬忠,美国纽约学院博士,加拿大加州学院博士后。 上海市海外高层次B类人才。 曾任上海Segno生物技术有限公司首席科学家/首席董事,曾任上海妻子基因工程有限公司创始人/总经理,日本Lynx制药公司中级研究员。
如有侵权请联系删除!
Copyright © 2023 江苏优软数字科技有限公司 All Rights Reserved.正版sublime text、Codejock、IntelliJ IDEA、sketch、Mestrenova、DNAstar服务提供商
13262879759

微信二维码